文|财新周刊 徐路易
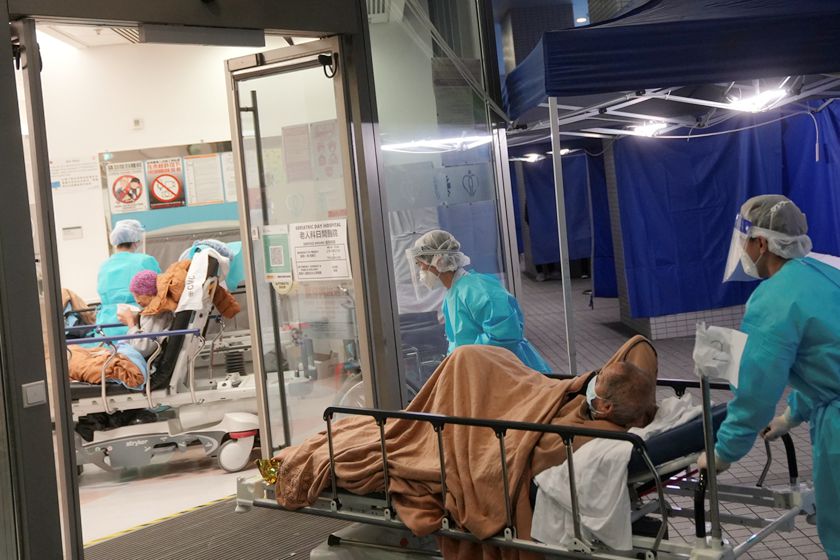
一种新药从研发到上市一般要经过五个阶段:候选药物研发、临床前研究、临床试验(Ⅰ期、Ⅱ期、Ⅲ期)、审批上市和上市后监测(Ⅳ期临床试验)。在新药物进入人体也就是临床试验阶段之前的非临床研究阶段,动物实验长期以来一直是测试、评估药物有效性和安全性的主要方法。
早在先秦时期,就有记载人们通过动物鉴定食物毒性,以及通过动物实验筛选药材。到了20世纪,动物实验更成为一些国家法律规定的新药研发“标配”。比如1938年,美国法律规定新药进行人体临床试验前,必须在动物身上做安全性和有效性测试。荷兰内梅亨大学实验室动物科学教授梅雷尔·霍廷加曾撰文介绍,当时的历史背景是有人因一种溶解在防冻液中的抗生素中毒而死,同时为了避免重复纳粹残忍的人体医学试验和药物沙利度胺引起的胎儿发育问题,美国食品药品监督管理局(FDA)制定了上述规则。